Piezo1 is a mechanically activated ion channel and mediates pressure induced pancreatitis
Keywords: Piezo1; Pancreatic acinar cells; Pressure; Pancreatitis.
胰腺對機械損傷極為敏感,相關臨床現象與機制研究不斷深入。手術操作、腹部鈍性創傷,以及內鏡逆行胰膽管造影術(ERCP)中胰管過度充盈等機械性刺激,均可能誘發胰腺炎。在機制方面,致病原因已從傳統認為的 “膽結石引發膽汁反流”,逐步明確為“胰管阻塞導致壓力升高”。由此可見,胰腺能夠感知機械力,腺體內壓力升高是胰腺炎的重要致病因素。
新型壓力激活離子通道 Piezo1 和 Piezo2 的發現,引發了對胰腺中是否存在類似機械激活離子通道的思考。Piezo1 和 Piezo2 在多種組織中廣泛表達,其中 Piezo1 在肺、膀胱和皮膚中表達量較高。Piezo1 由約 2500 個氨基酸構成,具有復雜的跨膜結構,可形成同源三聚體,其胞外結構域被認為是力傳感部位。研究表明,Piezo1 能響應多種機械力刺激,對鈣離子有選擇性,其激活可被 GsMTx4 阻斷,但壓力增加能抵消這種抑制。同時,小分子 Yoda1 可在無機械拉伸條件下特異性激活 Piezo1,而對 Piezo2 無作用。
Piezo1 在多種組織中承擔重要生理功能,如在血管內皮中響應血流剪切應力,其基因缺失會導致胚胎發育異常及血管畸形;在膀胱中,Piezo1 可對機械牽張產生反應。盡管胰腺的機械感受機制尚不明確,但推測機械激活離子通道可能參與壓力誘發胰腺炎的過程。
基于此,美國達勒姆退伍軍人事務醫療中心及杜克大學內科學系的研究團隊通過向胰管內滴注 Piezo1 激動劑 Yoda1 來誘導胰腺炎,從而證明胰腺腺泡細胞表達機械感受器 Piezo1,并且在腺體內施加壓力會產生胰腺炎。研究成果發表在Nature communications 期刊題為“Piezo1 is a mechanically activated ion channel and mediates pressure induced pancreatitis”。

首先,為建立貼近臨床的胰腺壓力模型,研究團隊通過向胰管內輸注緩沖鹽溶液來模擬壓力刺激(圖 1a)。該方法避免了外部施壓(如擠壓)導致的組織損傷并發癥。實驗設定兩種壓力模式:以 5 μL / 分鐘速度輸注 10 分鐘形成 7-11 mmHg 的低壓輸入,及以 80 μL / 分鐘速度輸注 5 分鐘形成 25-33 mmHg 的 高壓輸入。在鹽溶液中加入 1% 亞甲藍后觀察到,注射液可從胰頭擴散至胰尾(圖 1b)。據此研究人員于胰管注射 24 小時后采集胰腺中部組織進行分析。實驗結果顯示,高壓注射會導致胰腺重量增加、血清淀粉酶水平升高,代表中性粒細胞浸潤的 MPO 濃度顯著上升,組織學觀察可見中性粒細胞浸潤、水腫、出血及組織壞死等典型急性胰腺炎病理改變(圖 1c-f)。該研究證實,胰管內壓力升高是誘發急性胰腺炎的直接因素。

圖1 胰管內壓力導致急性胰腺炎。
然后,為了探究機械激活離子通道是否介導胰腺的壓力響應,研究團隊通過定量 RT-PCR 檢測了小鼠胰腺腺泡細胞中 TRPC、DEG/ENaC 和 Piezo 家族通道的表達,發現 Piezo1 的 mRNA 水平在各基因中最為豐富(圖 2a)。進一步通過共聚焦顯微鏡觀察小鼠胰腺組織冷凍切片,證實 Piezo1 蛋白存在于腺泡細胞表面,且可通過細胞形態及頂端酶原顆粒的胰蛋白酶染色明確腺泡細胞身份(圖 2b)。
為了探究 Piezo1 對胰腺腺泡細胞內鈣的調節作用,研究發現 Piezo1 激動劑 Yoda1 可顯著升高細胞內鈣濃度 [Ca2?] i,而機械敏感通道拮抗劑 GsMTx4 能抑制這一效應(圖 2c-e )。為驗證特異性,研究團隊構建了 Ptf1a 啟動子驅動的腺泡細胞特異性 Piezo1 敲除小鼠(Piezo1aci KO),他莫昔芬誘導后超 93% 腺泡細胞缺失功能性 Piezo1。該模型中,腺泡細胞對 Yoda1 刺激無 [Ca2?] i 響應,但對膽囊收縮素(CCK )刺激的鈣反應正常,證實 Piezo1 特異性介導機械刺激引發的細胞內鈣升高,而不影響其他信號通路的鈣調節功能。
為了驗證 Yoda1 對胰腺腺泡細胞中 Piezo1 的直接作用,研究人員通過檢測 LDH 釋放量評估細胞損傷。結果發現Yoda1 以劑量依賴性方式增加了 C57BL/6J 小鼠分離腺泡上清液中的 LDH 釋放量 ,而 EGTA 螯合細胞外鈣或 GsMTx4 預處理可阻斷該效應,這表明 Yoda1 對腺泡細胞的作用需要細胞外鈣。孵育 4 小時后,GsMTx4 仍能保護腺泡細胞免受細胞死亡(圖 2f)。為進一步探討 Piezo1 激活的潛在有害作用,研究了 Yoda1 對 Piezo1 基因缺失的腺泡細胞的影響。在 Piezo1 腺泡細胞特異性敲除小鼠(Piezo1aci KO)中,缺失功能性 Piezo1 的腺泡細胞wanquan抵抗 Yoda1 誘導的損傷(圖 2g)。
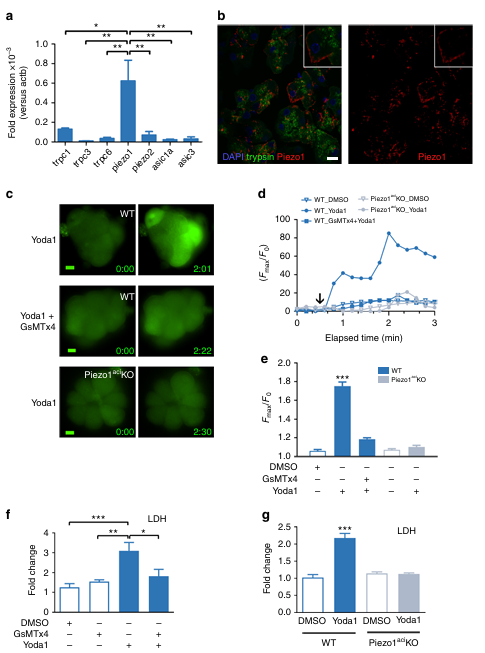
圖2 Piezo1 在胰腺腺泡細胞中表達。
接下來,為了進一步探究 GsMTx4 是否會改變體內壓力激活型胰腺炎模型中壓力的作用。研究人員在向胰腺施加壓力前 1 小時,腹腔注射 GsMTx4(270 μg/kg)。如圖 3 所示,所有由高胰管內壓力誘導的胰腺炎指標均因 GsMTx4 預處理而改善,這表明壓力對胰腺的有害作用涉及機械敏感離子通道的活性。

圖3 Piezo1 拮抗劑 GsMTx4 可減輕胰腺炎的嚴重程度。
為了明確 Piezo1 在急性胰腺炎中的核心作用,研究人員對 Piezo1 腺泡細胞特異性敲除小鼠(Piezo1aci KO)進行高胰管壓力刺激實驗。免疫染色證實 Piezo1aci KO 小鼠腺泡細胞表面 Piezo1 蛋白顯著缺失(圖 4),表明大多數腺泡細胞中 Piezo1 已被敲除。與野生型小鼠相比,Piezo1aci KO 小鼠在壓力刺激后,胰腺水腫、MPO 水平及組織學損傷(水腫、中性粒細胞浸潤、壞死、出血)均顯著減輕,其保護效果與 GsMTx4 藥物抑制相似。
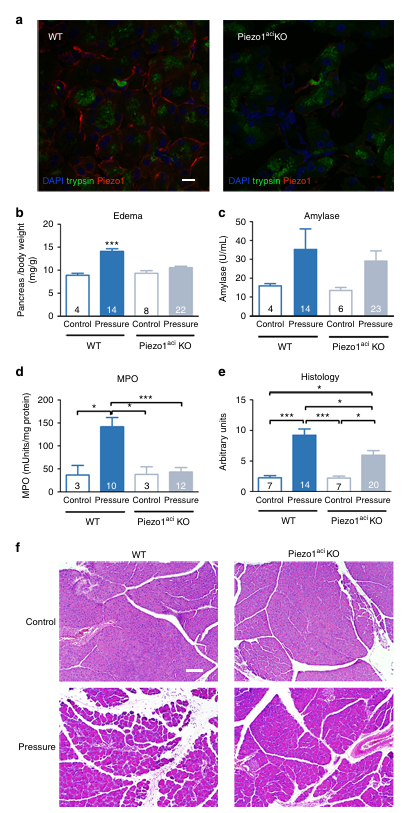
圖4 胰腺腺泡細胞中 Piezo1 的基因缺失可減輕胰腺炎的嚴重程度。
最后,為了驗證確定在無壓力情況下使用特異性 Piezo1 激動劑激活 Piezo1 是否能重現在高壓條件下觀察到的效應,研究人員在低壓條件下(胰管內壓≤11 mmHg,剪切應力可忽略)向野生型小鼠胰管注入 Piezo1 特異性激動劑 Yoda1(0.4 mg/kg,5 μL/min×10 min)。結果顯示,與載體處理組相比,Yoda1 處理組小鼠的所有胰腺炎參數均顯著增加 (圖 5a-d)。實驗顯示, Yoda1 在野生型小鼠中可誘發急性胰腺炎,但在腺泡細胞特異性敲除 Piezo1 的 Piezo1aci KO 小鼠中,Yoda1 無法引起水腫、淀粉酶升高、MPO 活性增強及組織學損傷等胰腺炎相關病理改變(圖 5a-d)。這些研究表明,施加于胰腺的壓力通過 Piezo1 誘發胰腺炎。

圖5 Piezo1 激動劑 Yoda1 誘導急性胰腺炎的特異性依賴于腺泡細胞 Piezo1 表達。
總之,研究揭示了胰腺機械刺激誘發胰腺炎的分子機制:胰腺腺泡細胞表達的機械感受器 Piezo1 在受壓后激活,通過介導鈣內流引發酶原過早激活與胰腺損傷。實驗證實,Piezo1 激動劑 Yoda1 可獨立誘導胰腺炎,而 Piezo1 拮抗劑或腺泡細胞特異性基因缺失能阻斷這一過程。
參考文獻:Romac JM, Shahid RA, Swain SM, Vigna SR, Liddle RA. Piezo1 is a mechanically activated ion channel and mediates pressure induced pancreatitis. Nat Commun. 2018 Apr 30;9(1):1715. doi: 10.1038/s41467-018-04194-9. PMID: 29712913; PMCID: PMC5928090.
圖片來源:所有圖片均來源于參考文獻
小編旨在分享、學習、交流生物科學等領域的研究進展。如有侵權或引文不當請聯系小編修正。如有任何的想法以及建議,歡迎聯系小編。感謝各位的瀏覽以及關注!關注“Naturethink”公眾號,了解更多相關內容。
相關產品
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號



















 采購中心
采購中心