各位讀者好,今天為大家帶來一篇使用綜合運用網絡毒理學和網絡藥理學等前沿研究手段來研究α-硫辛酸(LA)在砷誘導雞肝損傷中的保護作用、潛在靶點和機制的高分文章,是由山西農大張建海教授團隊2025年1月在Advanced Science發表的,題為“α-Lipoic Acid Ameliorates Arsenic-Induced Lipid Disorders by Promoting Peroxisomal β-Oxidation and Reducing Lipophagy in Chicken Hepatocyte”。深入探究了砷(As)誘導肝損傷的潛在機制,以及α-硫辛酸(LA)發揮肝保護作用的奧秘,并且對過氧化物酶體 β-氧化和脂質吞噬在其中的作用機制進行了驗證,為開發LA作為預防和治療砷致肝損傷的藥物提供了有力的理論支撐。
發表雜志:
《Advanced Science》是一本由 Wiley 出版的開放獲取跨學科科學期刊,創刊于 2014 年。該期刊在材料科學、化學、物理等領域具有較高的影響力和認可度。

![]()
2025 年影響因子:14.1
ISSN:2198-3844
中科院分區:中科院分區為大類學科材料科學 1 區、化學 1 區、工程技術 1 區,小類學科納米科技、化學綜合、材料綜合均為 1 區。
發文量:每年出版文章數約1065篇
發表成本:若文章被接受并發表,需支付APC費用,為6730美元/ 4480英鎊/ 5640歐元。
審稿周期:平均為12周,部分稿件可能因主題復雜性等因素而有所不同。
《Advanced Science》作為 Wiley 旗下的旗艦期刊,它以嚴格的同行評審流程保障學術質量,以涵蓋從微觀材料設計到宏觀工程應用的廣泛學科視野,為不同領域的頂尖研究提供了高效的交流平臺。其穩定的高影響因子、高 ESI 高被引論文占比及顯著的zhuan利轉化率,不僅彰顯了所刊成果的學術影響力與應用價值,更使其成為科研工作者衡量研究水平、提升學術聲譽的重要biao桿。同時,對中國科研力量的高度認可與友好態度,也讓它成為連接國內頂尖成果與國際學術舞臺的關鍵紐帶,持續助力全球科技創新的融合與發展。
研究背景:
肝臟疾病對全球公共衛生構成重大威脅,在禽類產業中也導致顯著經濟損失。砷是常見環境金屬污染物,長期暴露會損害肝臟結構和功能。過氧化物酶體β-氧化在肝臟代謝中起關鍵作用,但其在砷誘導肝損傷中的作用不明。脂噬與過氧化物酶體β-氧化在脂質代謝中的關系也有待明確。α-硫辛酸(LA)具有抗氧化等多種功能,但對雞砷暴露致肝損傷的干預效果和機制不清楚。因此,開展本研究以闡明相關機制。
本文采用網絡毒理學和網絡藥理學方法,綜合分析砷誘導雞肝損傷的機制以及α-硫辛酸(LA)的保護作用。通過多種技術觀察LA對砷致肝損傷中肝臟砷含量、組織形態、脂質代謝等的影響。結果表明,砷抑制SIRT1表達等導致脂質沉積和肝損傷,而LA靶向SIRT1,增強過氧化物酶體β-氧化、減少脂噬,緩解砷誘導的肝損傷,為LA作為潛在保肝劑提供理論依據。
研究框架:
1.提出問題:
探究砷誘導雞肝損傷的機制以及α-硫辛酸對其的保護作用和機制。
2. 研究框架:
建立雞砷暴露和α-硫辛酸干預模型,從網絡毒理學和網絡藥理學層面分析,結合多種實驗技術觀察指標變化。
3. 研究方法:
運用網絡毒理學和網絡藥理學,以及HE和油紅O染色、免疫熒光雙染色等技術。
4. 分析數據:
對實驗所得數據進行統計分析,比較不同組間差異,如ANOVA等。
5. 研究結論:
研究發現LA靶向SIRT1,改善線粒體損傷,增強β-氧化,調節脂質代謝,抑制脂噬,減輕砷誘導的肝損傷,為LA作為潛在保肝劑提供了理論依據。

結果解析:
1. As網絡毒理學分析結果
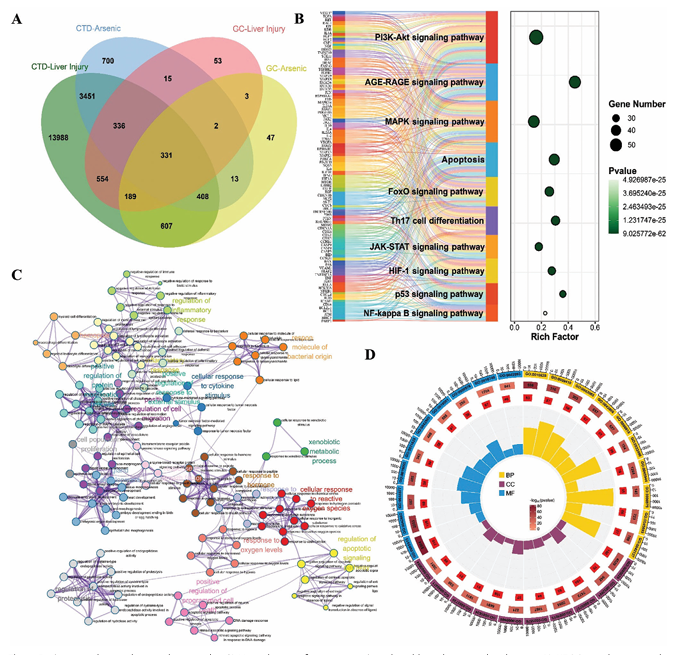
基因篩選:通過比較毒理基因組數據庫(CTD)和GeneCards數據庫篩選出754個As相關靶基因和1410個肝損傷相關靶基因,二者交集得到331個重疊靶基因。
功能富集分析:GO富集分析顯示這些基因主要與基因表達的正調控、細胞凋亡調控、氧化應激反應等生物過程,細胞質、細胞核等細胞組分,以及蛋白質結合、酶結合等分子功能相關;KEGG富集分析表明涉及PI3K - Akt信號通路、凋亡過程等關鍵通路,提示As主要通過調控相關通路影響肝細胞的多種生物學過程從而誘導肝損傷。
2. As暴露和LA干預對雞生長狀態、肝臟結構和功能的影響
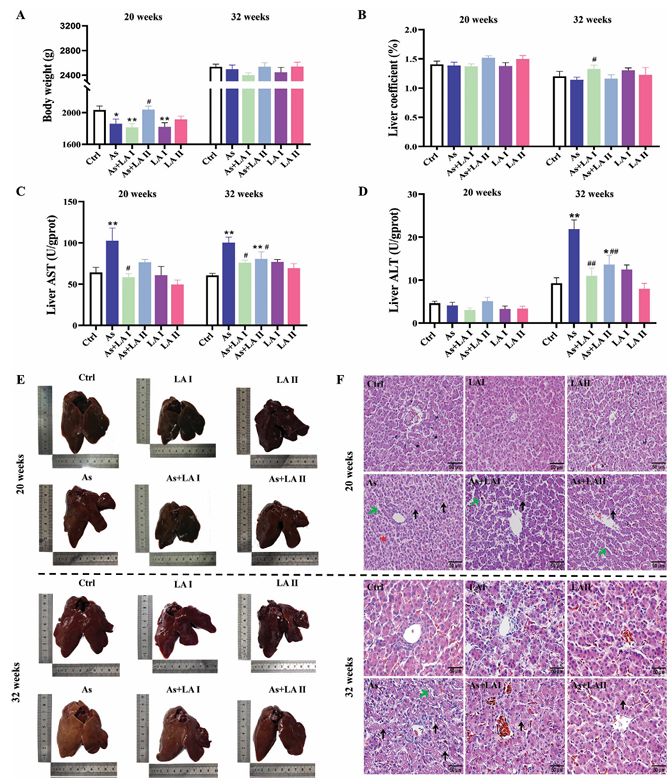
生長指標:20周處理后,As導致雞體重下降、肝臟中天冬氨酸氨基轉移酶(AST)含量增加,400 mg kg?1 LA干預可增加雞體重、降低AST含量;32周處理后,As明顯升高肝臟中AST和丙氨酸氨基轉移酶(ALT)水平,LA干預可顯著緩解這些升高。
病理形態學:As暴露20和32周后,肝臟顏色變淺、肝索排列紊亂、脂滴增多、肝細胞核溶解和固縮,LA干預可有效改善這些病理形態學改變,400 mg kg?1 LA的保護作用更明顯。
3. LA網絡藥理學分析結果
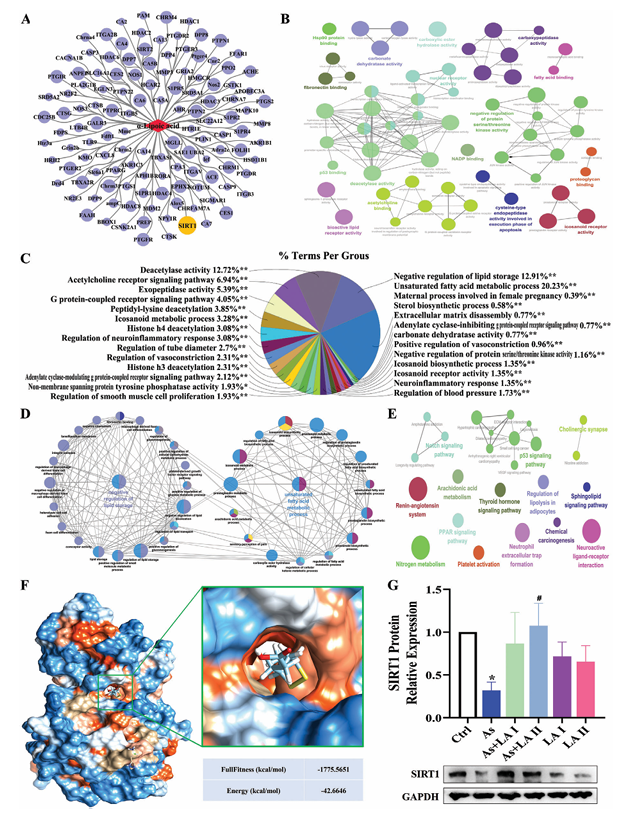
靶基因篩選:在Swiss Target Prediction和TargetNet數據庫中篩選出125個概率>0的LA潛在靶基因。
功能富集分析:GO富集分析顯示LA主要作用于與脂質代謝相關的術語,與不飽和脂肪酸代謝過程和脂質儲存的負調控關系最為密切;KEGG富集分析表明與PPAR信號通路、P53信號通路等脂質代謝相關途徑有關。
關鍵靶點:分析顯示SIRT1是LA的關鍵靶點,分子對接結果表明SIRT1蛋白有多個可與LA穩定結合的結合口袋,且結合能低。蛋白質驗證顯示As暴露后SIRT1蛋白表達水平顯著降低,LA干預可逆轉這一變化,提示LA主要通過調節脂質代謝改善肝損傷,SIRT1在其中起重要作用。
4. As暴露和LA干預對雞肝臟脂質代謝的影響
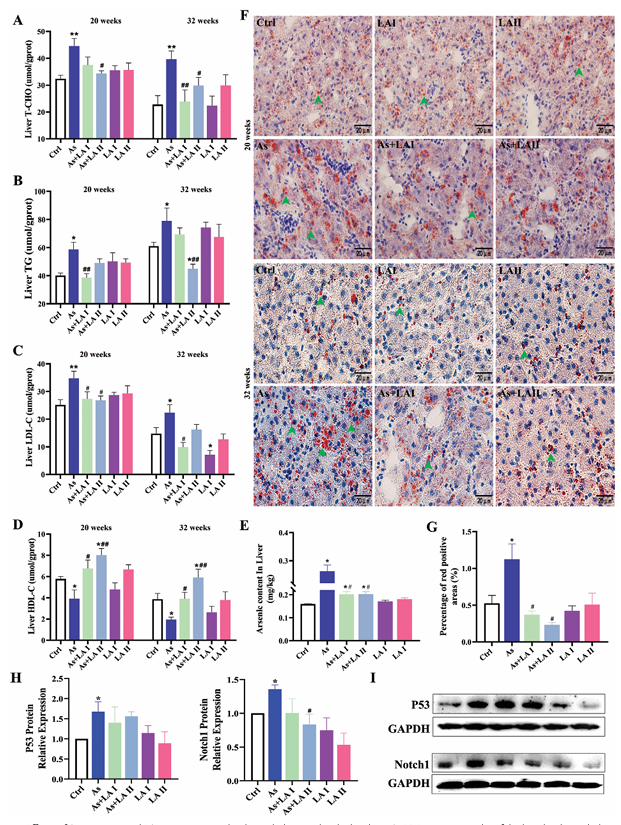
脂質指標檢測:As暴露20和32周后,顯著促進肝臟中甘油三酯(TG)、總膽固醇(T - CHO)和低密度脂蛋白(LDL)的積累,降低高密度脂蛋白(HDL)水平,LA添加可有效逆轉這一趨勢,400 mg Kg?1 LA干預組效果尤其顯著。
染色結果:Oil Red O染色結果顯示As處理后肝臟中脂質(紅色陽性區域)含量和脂滴數量增加,LA干預顯著降低肝臟脂質含量。
信號通路相關蛋白:As暴露顯著升高肝臟中P53和Notch1蛋白表達水平,LA干預可有效降低這兩種蛋白的表達,提示LA可緩解As誘導的肝臟脂質代謝紊亂,這一過程受P53和Notch通路調節。
5. As暴露和LA干預對雞肝臟過氧化物酶體β-氧化的影響
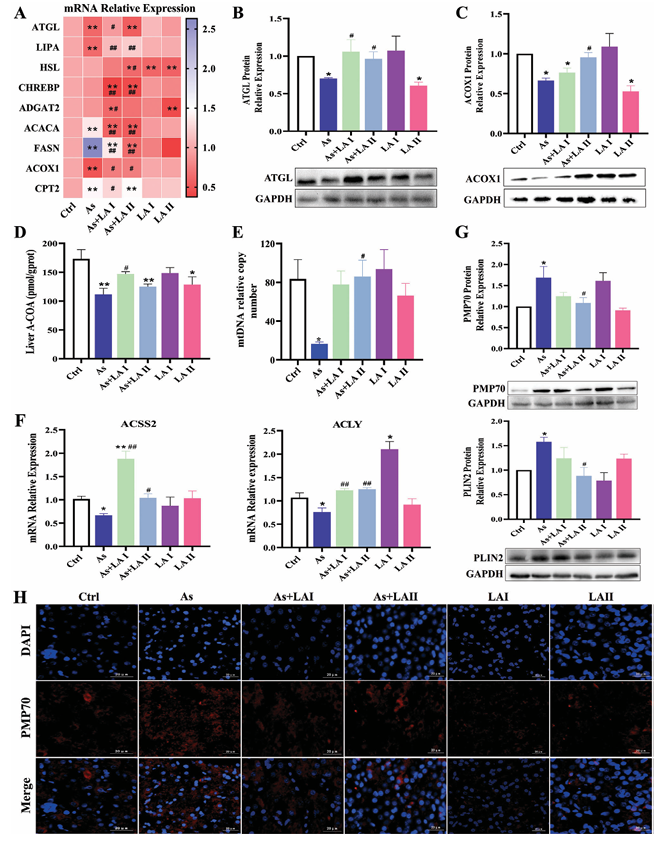
基因表達檢測:As增加肝臟中從頭脂質合成關鍵基因(ACACA和FASN)的mRNA表達,降低脂質分解(ATGL、LIPA)和脂質氧化(ACOX1、CPT2)關鍵基因的mRNA表達;LA干預后,ATGL、LIPA和ACOX1的mRNA表達水平顯著增加,ACACA、FASN和CPT2的mRNA表達水平明顯低于As組。蛋白質表達檢測結果與mRNA檢測結果一致。
代謝產物檢測:As處理顯著降低乙酰輔酶A(acetyl - CoA)和線粒體DNA(mtDNA)含量,LA添加可有效逆轉這種降低;As明顯降低肝臟中乙酰輔酶A合成關鍵基因(ACSS2和ACLY)的mRNA表達水平,LA干預顯著上調ACSS2和ACLY的mRNA表達。
過氧化物酶體相關蛋白:LA干預顯著降低As誘導的過氧化物酶體表面受體PMP70和脂滴表面受體PLIN2蛋白表達水平的增加;免疫熒光染色顯示As處理增加肝臟中過氧化物酶體數量,LA干預可有效逆轉這一變化,表明過氧化物酶體β-氧化參與了LA緩解As誘導的脂質沉積過程。
6. As暴露和LA干預對雞肝臟脂肪自噬的影響
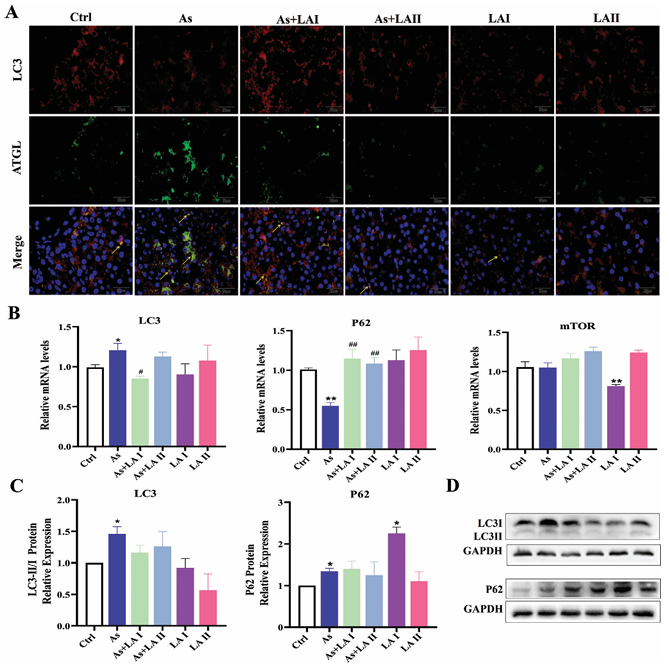
免疫熒光實驗:免疫熒光實驗中,用ATGL和LC3分別定位脂滴和自噬體以共定位脂肪自噬。結果顯示As組脂肪自噬的熒光強度比對照組增強,表明脂肪自噬增加;LA干預組的熒光強度比As組減弱。
基因和蛋白表達:與對照組相比,As組脂質滴中關鍵自噬基因LC3的mRNA表達顯著增加,P62的mRNA表達顯著降低;與As組相比,LA干預組LC3和P62的mRNA表達水平變化得到緩解。蛋白質印跡結果與基因結果相似,提示As暴露通過增加脂肪自噬誘導肝細胞損傷,LA可減少脂肪自噬并緩解這種損傷。
7. 雞肝細胞系(LMH細胞系)機制研究模型的建立
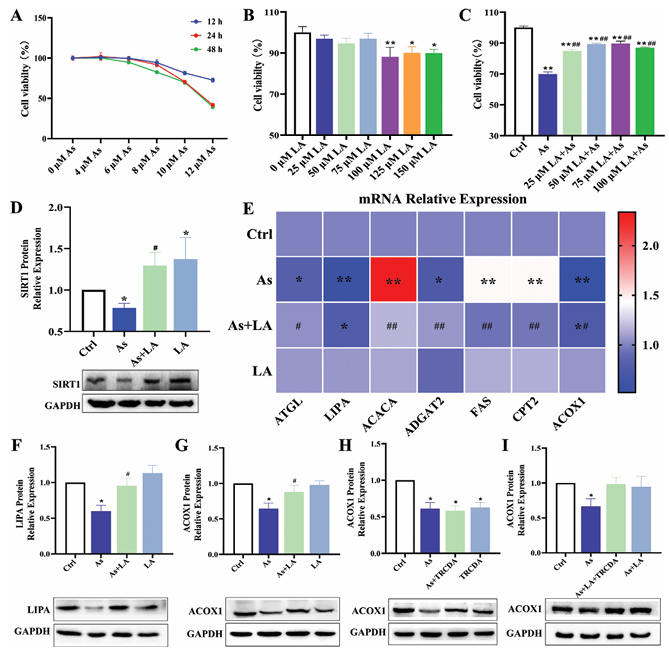
細胞增殖實驗:CCK-8實驗結果顯示,隨著As單獨處理的濃度增加和處理時間延長,肝細胞增殖率顯著降低;隨著LA單獨處理的濃度增加,細胞增殖率相應降低,但25、50、75和100 μM LA干預可顯著緩解As處理導致的肝細胞增殖率下降。
關鍵蛋白表達:As下調SIRT1表達,LA可有效上調SIRT1表達,與體內實驗結果一致。
脂質代謝相關基因表達:As處理增加肝細胞中ACACA、FAS和CPT2的mRNA表達,降低ATGL、LIPA、ADGAT2和ACOX1的mRNA表達;As和LA聯合處理可改善As誘導的這些變化。蛋白質表達檢測結果與mRNA檢測結果一致,提示LA在細胞水平上對改善脂質代謝紊亂具有與體內相似的作用。
過氧化物酶體β - 氧化抑制實驗:用ACOX1抑制劑TRCDA建立過氧化物酶體β-氧化的機械模型,結果顯示LA干預可增加As處理降低的ACOX1蛋白表達,TRCDA處理進一步降低肝細胞中ACOX1蛋白表達,表明TRCDA抑制過氧化物酶體β-氧化,其參與了As誘導的肝毒性調節和LA對肝臟的保護作用。
8. TRCDA處理對As和/或LA暴露下肝細胞功能、脂質代謝、活性氧(ROS)含量和細胞死亡的影響
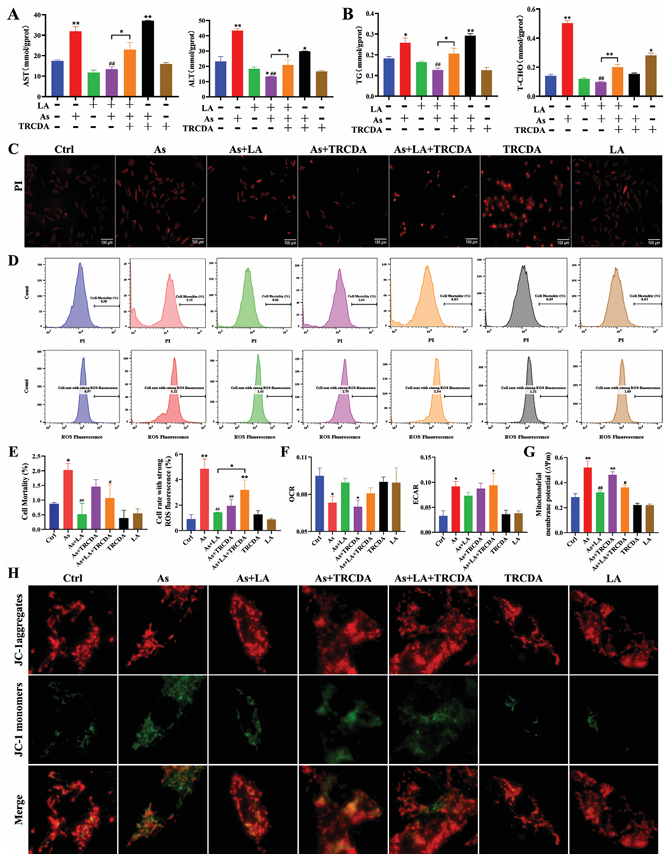
指標檢測:As處理顯著增加肝細胞中肝功能指標(AST和ALT)、脂質代謝指標(TG和T-CHO)、細胞死亡率、ROS含量、細胞外酸化率(ECAR)和線粒體膜去極化率,降低氧消耗率(OCR);As + LA組中這些指標的含量和比率顯著降低,且OCR和ECAR與對照組無顯著差異。
抑制作用驗證:TRCDA處理抑制LA對As改變的上述指標的緩解作用,并傾向于加劇As誘導的AST和TG水平升高,進一步驗證了LA對As誘導的肝臟脂質代謝紊亂和線粒體損傷的保護作用,以及過氧化物酶體β-氧化在這一過程中的調節作用。
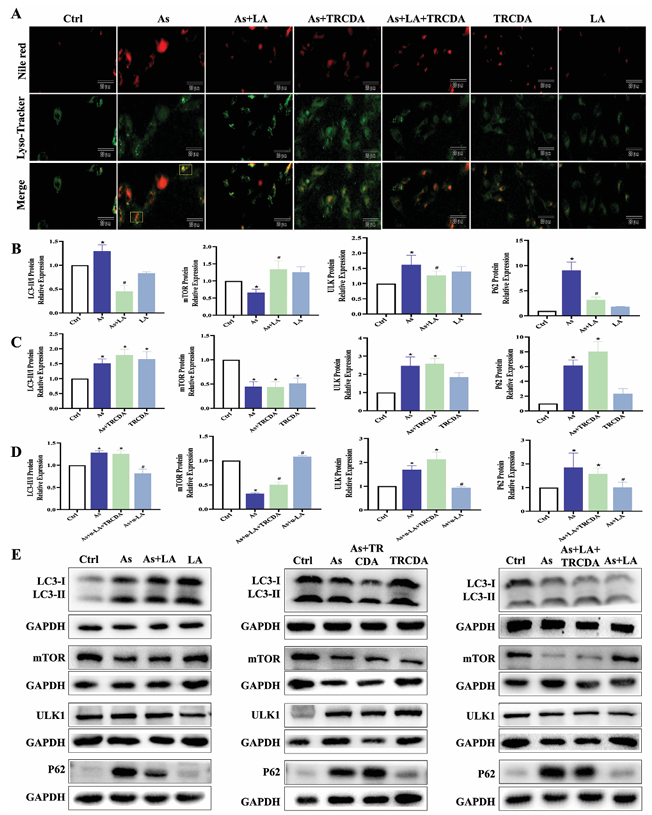
9. TRCDA處理對As和/或LA暴露下肝細胞脂肪自噬的影響
免疫熒光實驗:As處理顯著增加肝細胞中脂肪自噬熒光斑點的強度和數量,升高脂質滴中LC3、ULK和P62的蛋白質表達水平,降低mTOR的蛋白質表達水平,LA干預可緩解As誘導的這些變化。
抑制作用驗證:TRCDA處理進一步促進As誘導的脂肪自噬相關指標的變化,抑制LA對As誘導的脂肪自噬的改善作用,提示過氧化物酶體β-氧化調節脂肪自噬,在LA改善As誘導的肝損傷中起重要作用。
研究結論:
砷抑制SIRT1表達,激活P53和Notch通路,損傷線粒體和抑制過氧化物酶體β-氧化,導致脂質沉積和肝損傷。LA靶向SIRT1,改善線粒體損傷,增強β-氧化,調節脂質代謝,抑制脂噬,減輕砷誘導的肝損傷,400 mg kg?1效果更佳。
研究的創新性:
綜合運用網絡毒理學和網絡藥理學方法,明確了過氧化物酶體β-氧化和脂噬在砷致肝損傷及LA保護中的作用,為研究砷肝毒性和LA保肝機制提供新視角。
研究的不足之處:
文章主要采用雞作為實驗動物,不能wan全代表人類情況;文中僅發現過氧化物酶體β - 氧化抑制劑TRCDA能影響脂噬,但具體的信號傳導和調控網絡仍不清楚。 此外,研究主要基于動物實驗和細胞實驗,缺乏臨床研究的驗證來證實LA是否能作為有效的保肝藥物應用于臨床治療As誘導的肝損傷。
研究展望:
進一步探索過氧化物酶體β-氧化調節脂噬的關鍵途徑和內在機制;研究LA在其他動物模型或人體中的保肝效果和機制;優化LA的使用劑量和方式,提高其應用價值。
研究意義:
本研究進一步闡明了砷致肝損傷的機制和LA的保肝作用機制,為LA作為潛在治療砷致肝損傷的藥物提供理論依據,對肝臟疾病研究有重要參考價值。
免責聲明
- 凡本網注明“來源:化工儀器網”的所有作品,均為浙江興旺寶明通網絡有限公司-化工儀器網合法擁有版權或有權使用的作品,未經本網授權不得轉載、摘編或利用其它方式使用上述作品。已經本網授權使用作品的,應在授權范圍內使用,并注明“來源:化工儀器網”。違反上述聲明者,本網將追究其相關法律責任。
- 本網轉載并注明自其他來源(非化工儀器網)的作品,目的在于傳遞更多信息,并不代表本網贊同其觀點和對其真實性負責,不承擔此類作品侵權行為的直接責任及連帶責任。其他媒體、網站或個人從本網轉載時,必須保留本網注明的作品第一來源,并自負版權等法律責任。
- 如涉及作品內容、版權等問題,請在作品發表之日起一周內與本網聯系,否則視為放棄相關權利。
 手機版
手機版 化工儀器網手機版
化工儀器網手機版
 化工儀器網小程序
化工儀器網小程序
 官方微信
官方微信 公眾號:chem17
公眾號:chem17
 掃碼關注視頻號
掃碼關注視頻號














 采購中心
采購中心